




本土化发展的机遇与挑战:中国医药研发趋势.pdf
50墨值下载

本土化发展的机遇与挑战
中国医药研发趋势
中国医改虽然取得了显著的成效
,
但医疗保健体系在质量与覆盖方面仍存在不足
。
与此同时
,
人口的
不断增长和老龄化
,
以及医保系统运作效率等方面的问题使得现有体制面临着巨大的挑战
。
从提高质
量的角度看
,
政府的一个应对战略是继续支持本土医药的研发创新并重点关注创新能力的培养
,
应用
技术的升级
,
以及如何吸引
,
培养和保留优秀人才
。
这一战略对跨国制药公司影响巨大
。
他们亟待采纳
更多的本土化研发模式
,
以应对新的机遇和挑战
。
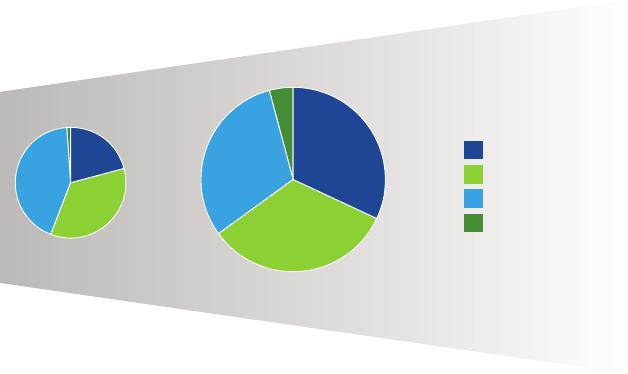
表1:中国研发药品数目增长 (2011-2014)
资料来源
:
中国食品药品监督管理总局-药品评估中心
,
德勤摩立特分析
变化的格局-主要影响
中国政府采用多管齐下的投资方式
,
积极发展当
地的研发产业
,
不仅促进了本土研发成果的发
展
,
刺激了新型研发创新模式的开发
(
表1
),
同时增强了中国在支持全球和区域研究中的重
要地位
。
1%
4%
33%
32%31%
35%
21%
43%
2011
2014
5,877
申请数目
7,829
申请数目
创新
仿制药
标签更改
其他
伴随研发竞争和监管复杂性的加剧
,
日益发展
的本土研发产业已经对跨国药企以成熟市场为
中心的传统研发模式构成了挑战
。
尽管中国政
府做出长期承诺
—
保证缩短创新产品进入市场
的周期
,
但政策的施行和影响程度仍然存在很
大的不确定性
。
因此
,
跨国药企需要考量在中
国执行更为本土化的研发战略
。
这一战略将借
助不断增强的本地研发能力以本土市场的开
发
,
以及缩短产品进入中国市场的周期
。
研发监管政策的变革
海外临床项目在中国本土启动本土临床研究历
来面临两大难题
:
中国食品药品监督管理总局
(
CFDA
)
要求药品必须已在国外注册或正在II
期或III期临床试验中
;
和相比其他国家而言
,
十分漫长的临床研究申请
(
IND
)
和新药申请
(
NDA
)
流程
。
这些阻碍可能导致新产品在中
国上市延迟五到八年
,
侵蚀专利保护带来的效
益
,
从而打击创新项目在中国市场的推出
。
尽管政府正在加快在研发方面的监管改革
,
但行业内仍存在较大的波动
,
并有望持续
。
比如
,
在2014年C
FDA和以研发为主的中国外
商投资企业协会药品研制和开发行业委员会
(
RDPAC
)
进行了若干次讨论
。
尽管最近CFDA
发布了一个关于加速癌症药物临床批文
(
IND
)
的试点项目
,
并表示有计划将报批时间从一至
两年缩短到60天
,
它对海外项目在中国申请临
床试验的影响仍然未知
,
并且改革的具体内容
和开展时间安排仍有待进行进一步的明晰
。
此
外
,
中央或地方监管机构是否有能力实施改革
始终被视为一大挑战
,
这可能会在短期内加剧
行业的波动
。
中国政府对药物研发监管的政策变动对希望在
华引入创新项目的跨国制药企业有重大影响
。
公司必须及时调整目前的全球研发模式
,
以减
轻中国本土政策环境带来的效益风险
。
对“中国为中国制造”药品的需求加大
解决中国患者日益增长的未满足需求是加快
CFDA批准流程的一个关键要素
。
针对许多未受
重视但发展迅速的治疗领域
,
如肝癌和胃癌
(
表
2
),
如果能在中国大陆取得令人满意的临床效
果
,
加上全球临床研究提供的亚洲人群数
据
,
或
许可以证明其具备加速审批的资质
。
2
of 8
50墨值下载
【版权声明】本文为墨天轮用户原创内容,转载时必须标注文档的来源(墨天轮),文档链接,文档作者等基本信息,否则作者和墨天轮有权追究责任。如果您发现墨天轮中有涉嫌抄袭或者侵权的内容,欢迎发送邮件至:contact@modb.pro进行举报,并提供相关证据,一经查实,墨天轮将立刻删除相关内容。
下载排行榜

评论